Ricerca di base sul CBD
1. Che cosa è il sistema endocannabinoide?
Il sistema endocannabinoide è un complesso sistema endogeno di comunicazione tra cellule. Esso è composto da recettori endocannabinoidi, i loro ligandi endogeni (gli endocannabinoidi) e le proteine coinvolte nel metabolismo e nel trasporto degli endocannabinoidi. Questo sistema è di grande importanza per il normale funzionamento dell’organismo. In base alla localizzazione dei recettori, è stato ipotizzato che il sistema endocannabinoide sia coinvolto in un gran numero di processi fisiologici, tra i quali il controllo motorio, la memoria e l’apprendimento, la percezione del dolore, la regolazione dell’equilibrio energetico, e in comportamenti come l’assunzione di cibo. Altre funzioni del sistema endocannabinoide, nella normale fisiologia, potrebbero essere correlate alle funzioni endocrine, alle risposte vascolari, alla modulazione del sistema immunitario, alla neuroprotezione.
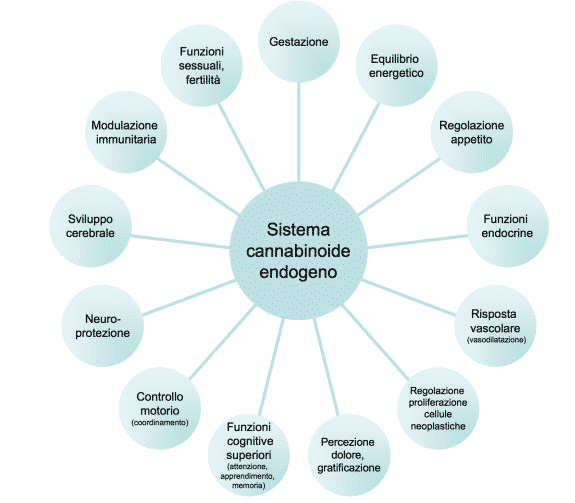
Figura 1 – Le principali funzioni del sistema endocannabinoide in normali condizioni fisiologiche.
Il sistema cannabinoide svolge dunque diverse funzioni, secondo il tessuto in cui agisce, ma l’obiettivo non cambia è consiste nel determinare l’omeostasi, il mantenimento di un ambiente interno stabile a fronte di fluttuazioni nell’ambiente esterno.
I cannabinoidi promuovono l’omeostasi ad ogni livello della vita biologica, da quello subcellulare, all’organismo stesso, e probabilmente a tutta la comunità, e anche a livelli superiori. Ad esempio, l’autofagia, il processo in cui una cellula isola parte del suo contenuto per auto-digerlo e riciclarlo, viene mediata dal sistema cannabinoide. Tale processo non solo mantiene vive le cellule normali, permettendo loro di stabilire un equilibrio tra sintesi, degradazione e riciclo dei prodotti cellulari, ma ha anche un effetto letale sulle cellule tumorali maligne, poiché le induce ad autoconsumarsi in un’apoptosi, una necrosi cellullare programmata. La morte delle cellule tumorali promuove l’omeostasi e quindi la sopravvivenza dell’intero organismo.
Gli endocannabinoidi e i cannabinoidi si trovano inoltre all’intersezione dei vari sistemi del corpo umano e assicurano la comunicazione e il coordinamento tra diversi tipi di cellule. Nell’area di una lesione, ad esempio, i cannabinoidi diminuiscono il rilascio di attivatori e sensibilizzatori da parte del tessuto danneggiato, stabilizzando le cellule nervose, evitando una loro eccessiva scarica, e al contempo calmando le cellule immunitarie limitrofe impedendo il rilascio di sostanze pro-infiammatorie. Si tratta quindi di tre meccanismi d’intervento su tre tipi cellule diverse, finalizzati ad uno scopo unico: ridurre al minimo il dolore e il danno dalla lesione.
Il sistema endocannabinoide, con la sua complessa azione sul sistema immunitario, su quello nervoso, e su tutti gli organi del corpo, rappresenta un vero e proprio ponte tra corpo e mente. La comprensione di questo sistema ci consente anche di capire il meccanismo che spiega come un particolare stato mentale possa promuovere la salute o la malattia.
Non regolano soltanto l’omeostasi interna e cellulare, ma i cannabinoidi influenzano anche il rapporto che una persona istituisce con l’ambiente esterno. La somministrazione di cannabinoidi ha un chiaro impatto sul comportamento sociale, e spesso promuove la propensione alla condivisione, allo humor e alla creatività. Con il loro ruolo di mediatori nella neurogenesi, nella plasticità neuronale e nell’apprendimento, i cannabinoidi possono influenzare direttamente l’apertura mentale di una persona e la sua capacità di superare schemi limitanti e derivati da comportamenti e situazioni del passato. In un ambiente in continuo e rapido cambiamento, la rigenerazione di questi vecchi schemi costituisce un elemento essenziale per la nostra salute.


Tabella 1: Funzioni in cui è coinvolto il sistema endocannabinoide in normali condizioni fisiologiche
Che cosa sono i recettori cannabinoidi?
Nella Cannabis Sativa, pianta erbacea annua appartenente alla famiglia delle Cannabinacee, sono state individuate numerose sostanze chimiche tra cui il cannabinolo e il TCH o delta-9-tetraidrocannabinolo. Il THC è il componente attivo più noto della Cannabis è un composto che agisce sul sistema nervoso centrale inducendo euforia, distorsione della percezione temporale, alterazione delle percezioni uditive e visive, sedazione ecc. Inoltre presenta altre azioni psicoattive che possono essere utilizzate a scopo terapeutico: azione antidolorifica, antinausea, stimolante dell’appetito, riduttiva della pressione endooculare. Agisce inoltre su numerosi organi periferici quali i polmoni (dilatazione alveolare), cuore (tachicardia), apparato vascolare (vasodilatazione) e sistema immunitario (inibizione della funzione immunitaria). Gli studi sull’azione del delta-9-THC, isolato da Gaoni e Mechoulam nel 1964, portarono all’ipotesi che i cannabinoidi esogeni dovevano agire attraverso un sistema di recettori cellulari specifici. Nel 1990 Matsuda e colleghi identificarono nel cervello del ratto un recettore specifico capace di legare il THC: il CB1.
 Figura 2: Struttura recettore CB1.
Figura 2: Struttura recettore CB1.
Il corpo umano possiede specifici siti di legame per i cannabinoidi, distribuiti sulla superficie di molti tipi di cellule. Il nostro organismo produce i loro ligandi endogeni, chiamati endocannabinoidi, i quali si legano proprio ai recettori cannabinoidi (CB), attivandoli. Questi recettori appartengono alla numerosa famiglia dei recettori accoppiati alla proteina G (GPCR), superfamiglia della quale fa parte la maggioranza dei recettori più comuni. I GPCR sono recettori di membrana che consistono in sette domini trans membrana (7TM) con un terminale amminico extracellulare ed un terminale carbonilico intracellulare Fino a qualche anno fa si pensava che esistessero solo due tipi di recettori cannabinoidi, i CB1 scoperti nel 1990 e i CB2, scoperti qualche anno dopo, ma ci sono crescenti evidenze dell’esistenza di ulteriori recettori cannabinoidi sia a livello centrale che periferico. Uno di questi potrebbe essere il recettore “orfano” accoppiato alla proteina G, denominato GPR55.
I recettori cannabinoidi hanno differenti meccanismi di distribuzione tissutale e di segnalazione. I CB1 sono tra i più abbondanti e i più ampiamente distribuiti GPCR nell’encefalo. Si trovano principalmente sulle cellule nervose (neuroni) del SNC (oltre che nell’encefalo quindi, anche nel midollo spinale). A livello dell’encefalo, la distribuzione dei CB1 è particolarmente marcata nelle regioni responsabili della coordinazione motoria e del movimento (per esempio, il cervelletto, i gangli della base, nello specifico, lo striato e la substantia nigra), dell’attenzione e delle funzioni cognitive complesse come il giudizio (ad esempio, la corteccia cerebrale), dell’apprendimento, della memoria e delle emozioni (ad esempio, amigdala e ippocampo). I recettori CB1 sono presenti in minor quantità, anche in alcuni organi e tessuti periferici tra cui ghiandole endocrine, ghiandole salivari, leucociti, milza, cuore e parte dell’apparato riproduttivo, urinario e gastrointestinale.
Figura 3: Distribuzione dei recettori CB1 nel cervello. Nello specifico, le aree indicate con i puntini neri sono quelle in cui maggiormente si lega il cannabinoide esogeno THC modificandone il normale funzionamento. Fonte: NIDA.
A differenza dei CB1 invece, i recettori CB2 sono espressi principalmente a livello periferico. Sono presenti prevalentemente nelle cellule immunocompetenti, tra cui i leucociti, la milza e le tonsille, il midollo osseo ematopoietico, ma anche nel pancreas. Recentemente sono stati identificati anche nel SNC, pur se a basse concentrazioni in particolare sulle cellule gliali e microgliali. Il ruolo dei recettori cannabinoidi è essenzialmente quello di regolare il rilascio di altri messaggeri chimici. I recettori CB1 interferiscono con il rilascio di alcuni neurotrasmettitori e la loro attivazione protegge il SNC dalla sovrastimolazione o dalla sovrainibizione prodotta da altri neurotrasmettitori. I recettori CB2 invece, svolgono prevalentemente un’azione periferica con attività immunomodulatoria. Nel sistema immunitario, infatti, una delle funzioni dei recettori cannabinoidi è la modulazione del rilascio di citochine, molecole proteiche responsabili della regolazione della funzione immune e delle risposte infiammatorie.
Sebbene la scoperta del sistema endocannabinoide e dei suoi recettori sia un avvenimento recento, è stato osservato che, le ascidie, i minuscoli nematodi e tutte le specie di vertebrati hanno in comune il sistema endocannabinoide, che svolge una parte essenziale nei processi vitali e nell’adattamento ai cambiamenti ambientali. Il confronto della genetica dei recettori cannabinoidi in specie diverse ha permesso agli scienziati di capire che il sistema endocannabinoide era già sviluppato negli animali primitivi, circa 600 milioni di anni fa.
Tipi di cannabinoidi
Per quanto sia opinione comune che i cannabinoidi siano molto conosciuti, in realtà, soltanto da poco si comincia a far luce su questo tema (grazie a circa ventimila articoli scientifici). È probabile che nelle nostre attuali conoscenze vi siano grandi lacune e la complessità delle interazioni tra i vari tipi di cannabinoidi, i sistemi e gli organismi inducano gli scienziati a studiare in modo innovativo la fisiologia e la salute. La seguente rassegna presenta in breve ciò che effettivamente sappiamo.
Il termine cannabinoide si riferisce ad ogni composto che ha la capacità di interagire con i recettori cannabinoidi. Con la definizione di alcune sottocategorie chimiche è possibile prendere in considerazione varie forme di prodotti sia naturali che sintetici. Ad oggi sono state descritte tre tipologie di cannabinoidi: i cannabinoidi endogeni, i fitocannabinoidi, e i cannabinoidi sintetici realizzati in laboratorio a scopo terapeutico e/o di ricerca scientifica.
Con il termine cannabinoidi endogeni o endocannabinoidi si identifica una classe di messaggeri lipidici endogeni, accomunati dalla capacità di interagire con almeno uno dei recettori cannabinoidi a livello centrale o periferico, regolando alcune funzioni fisiologiche e comportamentali. Tutti gli endocannabinoidi sono derivati di acidi grassi polinsaturi, che si differenziano, nella struttura chimica, dai fitocannabinoidi. Gli endocannabinoidi al momento conosciuti sono i seguenti:
- N-arachidonoiletanolamide (anandamide, AEA)
- 2-arachidonoilglicerolo (2-AG)
- 2-arachidonil gliceril etere (noladina, 2-AGE)
- virodamina (O-arachidonoil etanolamina)
- N-arachidonoil-dopamina (NADA)
Gli endocannabinoidi sono derivati dall’acido arachidonico coniugato con etanolamina o glicerolo. L’anandamide è formata da un fosfolipide precursore, l’N-arachidonil-fosfatidil-etanolamide (NAPE), e il suo rilascio dal NAPE è catalizzato da una specifica fosfolipasi D (PLD). Il 2-AG è un monogliceride sintetizzato da una fosfolipasi C (PLC) fosfotidil-inositolo specifica 10 19. Dopo il rilascio, gli endocannabinoidi agiscono legandosi ai recettori dei cannabinoidi e successivamente vengono rapidamente inattivati tramite la ricattura e la degradazione enzimatica. La degradazione degli endocannabinoidi avviene mediante due enzimi specifici: la FAAH (fatty acid amide hydrolase) e MAGL (mono acil gliceride lipasi).
La FAAH degrada l’anandamide, mentre la MAGL degrada il 2-AG.

I fitocannabinoidi sono cannabinoidi di origine naturale, contenuti nella pianta di cannabis, alla quale devono il loro nome. Sono una classe di composti a struttura terpenofenolica, lipofili, quasi del tutto insolubili in acqua. È solo nell’era moderna che gli scienziati hanno scoperto i primi tipi di fitocannabinoidi. Il delta-9- tetraidrocannabinolo, o THC, è la sostanza psicoattiva più famosa, ma anche altri cannabinoidi, quali il cannabidiolo (CBD) e cannabinolo (CBN), stanno iniziando a richiamare l’attenzione dei ricercatori interessati alle loro proprietà curative. A tutt’oggi sono stati identificati più di 60 cannabinoidi, molti dei quali ancora poco studiati.
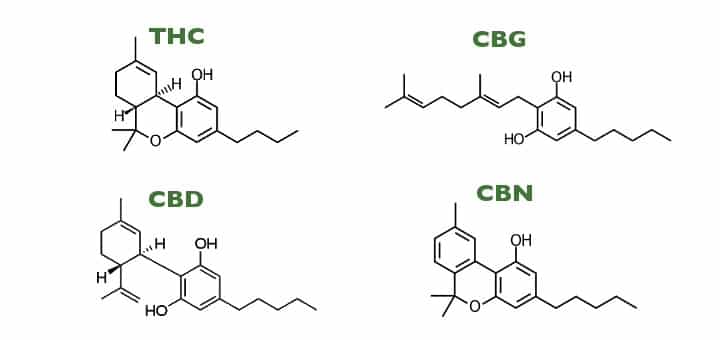
La distribuzione dei cannabinoidi varia nei differenti tipi di cannabis ed in genere, in una pianta, si trovano solo tre o quattro cannabinoidi in concentrazioni superiori allo 0,1%. Il tetraidrocannabinolo, il cannabidiolo, il cannabinolo, il cannabigerolo e il cannabicromene sono i fitocannabinoidi più rappresentati. I più studiati, oltre al tetraidrocannabinolo, sono il cannabidiolo e il cannabinolo, mentre per gli altri sono disponibili solo poche informazioni circa la loro attività biologica.
È interessante notare che la pianta stessa di marijuana impiega il THC e altri cannabinoidi per promuovere la propria salute e prevenire le malattie. I cannabinoidi hanno proprietà antiossidanti che proteggono le foglie e le strutture di gemmatura dalle radiazioni ultraviolette; i cannabinoidi proteggono le cellule, neutralizzando i radicali liberi dannosi generati dai raggi UV. Negli esseri umani, i radicali liberi causano l’invecchiamento, il cancro e rallentano la guarigione. Gli antiossidanti presenti in questa pianta sono stati da tempo promossi come integratori naturali nella prevenzione dei danni causati dai radicali liberi.
I principali fitocannabinoidi
Il THC è stato identificato per la prima volta nel 1964 da Gaoni e Mechoulam. Esso è considerato il cannabinoide psicoattivo della pianta di cannabis e dei suoi derivati, con attività agonista sia sui recettori cannabinoidi CB1 che sui CB2. Negli esseri umani il THC viene rapidamente convertito nell’11-idrossi-Δ9-THC, metabolita attivo nel Sistema Nervoso Centrale (SNC), nell’11-nor-9-carbossi-THC e nel cannabidiolo (Reynolds, 1982). L’11-idrossi-Δ9 -THC viene quindi convertito in metaboliti più polari, inattivi, tra i quali l’acido carbossilico 11-nor- Δ9-THC, che vengono escreti nelle urine e nelle feci. Il THC è un prodotto piuttosto instabile che decompone in una serie di molecole inattive, quando esposto all’aria o alla luce.
Il cannabinolo (CBN) deriva dalla ossidazione del THC e si trova in quantità crescenti nel tempo, nei prodotti di cannabis, man mano che questi invecchiano. Il CBN è presente in minime quantità nella cannabis fresca, e il rapporto CBN/THC può fornire un’indicazione sull’età dei prodotti di cannabis eventualmente analizzati.
Il cannabigerolo (CBG) è stato poco studiato fino ad ora, ma una recente pubblicazione ha dimostrato che possiede attività biologica su diversi recettori, in particolare è in grado di attivare l’α2-adrenocettore, di legarsi ai recettori cannabinoidi CB1 e CB2 e di bloccare i recettori 5-HT1A e CB1.
La cannabivarina (CBV) è presente in piccole quantità nella cannabis. Non ha proprietà psicoattive ed è un analogo del cannabinolo.
Oltre ai cannabinoidi, il profilo chimico della pianta di cannabis contiene altri composti, come i terpenoidi, amminoacidi, proteine, zuccheri, enzimi, acidi grassi, e flavonoidi, che agiscono insieme danno origine al cosiddetto effetto entourage,termine coniato nel 1998 dagli scienziati israeliani Shimon Ben-Shabbat e Meshullam Raffaello per descrivere il meccanismo per il quale i cannabinoidi della cannabis lavorano insieme sinergicamente, e influenzano il corpo in un modo simile all’azione del suo sistema endocannabinoide.
Questa teoria è la base per una idea relativamente controversa tra i farmacisti che sostengono che estratti provenienti da piante intere agiscono meglio come agenti terapeutici, piuttosto che i singoli estratti di cannabinoidi.
Che cosa è il CBD?
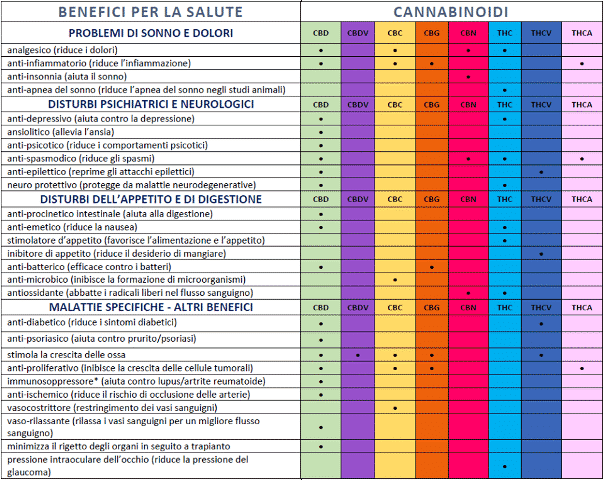
Il CBD è il secondo componente più importante nella pianta di cannabis. Molti dei benefici terapeutici della cannabis sono attribuiti al contenuto di CBD. Il CBD non è un cannabinoide psicoattivo come il THC, e le ricerche più recenti dimostrano che può perfino inibire gli effetti psicoattivi del THC. Grazie alle possibilità medicinali, innumerevoli test clinici sono stati condotti utilizzando il CBD come farmaco.
Applicazioni terapeutiche del CBD e dei cannabinoidi
Nonostante le diverse modalità di azione, il CBD e gli altri cannabinoidi avrebbero molti dei benefici del THC. Secondo una recensione sugli studi scientifici, pubblicata nel 2013 sul British Journal of Clinical Pharmacology, emerge che il CBD possiede le seguenti proprietà mediche:
1.1 Azione sul morbo di Parkinson
La malattia di Parkinson è una patologia neurodegenerativa cronica e progressiva del sistema nervoso centrale, tipicamente caratterizzata dalla presenza di sintomi motori cardinali quali bradicinesia, rigidità e tremore, ai quali si associa instabilità posturale. Il coinvolgimento prevalentemente motorio della malattia ne determina il suo usuale inquadramento tra i disordini del movimento. La eziopatogenesi della malattia di Parkinson (PD) è attualmente sconosciuta, ma considerevoli prove ne individuano una origine multifattoriale, che coinvolge fattori genetici e ambientali. Nel PD, così come nella maggior parte delle malattie ipocinetiche, il ganglio della base principalmente alterato è la substantia nigra, i cui neuroni dopamminergici degenerano. La conseguenza di questa degenerazione è un aumento dell’attività dei circuiti cerebrali che inibiscono il movimento, che dà luogo ai sintomi ipocinetici tipici di queste malattie. I farmaci a base di cannabinoidi sono stati proposti come terapie clinicamente promettenti nel PD, data la prominente funzione modulatoria svolta dal sistema di segnalazione cannabinoide nei gangli basali. Nonostante i promettenti studi preclinici per il PD, l’uso di cannabinoidi non è stato studiato ampiamente a livello clinico.
In uno studio condotto dal neurologo Evzin Ruzicka è stato chiesto a tutti i pazienti in cura per il Parkinson presso un centro di Praga di completare un questionario sull’uso di cannabis per i sintomidi questa patologia. Di 630 questionari inviati, 339 (54%) furono restituiti. Fra coloro che avevano risposto, il 25% riferiva di aver usato cannabis. La maggior parte l’aveva usata per bocca, come foglie fresche o secche. In questo gruppo, 39 pazienti (46%) riferirono che i sintomi della loro malattia in generale erano migliorati dopo che avevano iniziato a usare cannabis. 26 (31%) riferirono un miglioramento del tremore a riposo, e 38 (45%) un miglioramento della bradicinesia. Un sollievo della rigidità muscolare è stato riferito da 32 pazienti (38%), e 12 (14%) hanno detto di aver avuto un miglioramento nelle discinesie indotte dalla Levodopa. In genere, il miglioramento dei sintomi avvenne dopo 1-7 mesi in media dall’inizio dell’uso di cannabis. I pazienti che l’avevano usata per almeno 3 mesi avevano maggior probabilità di avere un sollievo dai sintomi di quelli che l’avevano usata per meno tempo.
Nel 2014, uno studio condotto su 21 pazienti affetti da PD ha evidenziato gli effetti terapeutici del CBD su questa patologia. La somministrazione di dosi di CBD da 300 mg/die ha portato ad un netto miglioramento della qualità di vita, se confrontato con il placebo.
Uno studio del 2013 ha evidenziato che il THC, rappresenta una valida opzione terapeutica per il PD aiutando nella prevenzione dei danni causati dai radicali liberi e attivando un recettore che incoraggia la formazione di nuovi mitocondri.
Nonstante questi risultati incoraggianti sono necessari ulteriori studi che confermino quanto sopra da condurre su coorte di pazienti molto più estese.
1.2 Azione antiepilettica
L’epilessia è un disturbo neurologico cronico caratterizzato dall’occorrenza di crisi epilettiche, definite come manifestazioni cliniche a occorrenza parossistica, ricorrenza imprevedibile nella maggioranza dei casi, di brevissima durata, caratterizzate da segni e/o sintomi dovuti a un’attività neuronale anomala. L’epilessia è un disturbo eterogeneo, le cui cause possono essere individuate fondamentalmente in:
- fattori genetici: caratterizzati da diverse modalità di trasmissione, localizzazione cromosomica e tipo di mutazione genetica implicata (alcune già note, molte del tutto sconosciute)
- fattori acquisiti: sofferenza pre-peri-post-natale; anomalie dello sviluppo corticale, esiti di traumi cranici, stroke, infezioni cerebrali e interventi neurochirurgici, tumori cerebrali e così via.
Le prime proprietà farmacologiche del CBD ad essere riconosciute sono quelle antiepilettiche e sedative. Nel 1973, un gruppo di ricercatori brasiliani ha riferito che il CBD svolge un ruolo attivo nel ridurre o bloccare le convulsioni indotte negli animali da laboratorio; tale scoperta è stata confermata l’anno successivo da altri ricercatori. Alla fine degli anni ‘70, lo stesso gruppo di ricercatori brasiliani ha testato il CBD per l’epilessia intrattabile in 16 pazienti affetti da crisi di tipo tonico-clonico. In un esperimento in doppio cieco, ai pazienti sono stati somministrati per quattro mesi e mezzo 200-300 mg/giorno di CBD oppure un placebo. Durante l’esperimento, i pazienti non avevano interrotto l’assunzione dei farmaci antiepilettici prescritti prima dell’esperimento (che non aveva eliminato le crisi epilettiche). Soltanto uno degli otto pazienti curati col CBD non ha mostrato alcun miglioramento, mentre tra i pazienti che hanno ricevuto il placebo, soltanto in uno di loro è stato riscontrato un miglioramento. In un altro esperimento, che ha riscosso meno successo, nessun miglioramento significativo della frequenza delle crisi è stata osservata nei 12 pazienti epilettici cui sono stati somministrati, oltre antiepilettici standard, 200- 300 mg di cannabidiolo al giorno.
Uno studio del 2013 riporta gli effetti negativi e positivi associati con l’utilizzo del’estratto di cannabis nei pazienti pediatrici. I pazienti presentavano quali effetti negativi affaticamento (37% dei casi) e sonnolenza (16% dei casi). Gli effetti positivi riscontrati sono di gran lunga superiori agli effetti negativi: miglioramento del sonno (68% dei casi); migliorata attenzione (74%); miglioramento dell’umore (79%). Gli effetti negativi generalmente associati con l’assunzione dei farmaci anti-epilettici invece non sono stati riscontrati in seguito all’assunzione di CBD.
Effetti positivi sono stati segnalati nel trattamento della sindrome di Dravet. I risultati della ricerca condotta dal NYU Langone’s Comprehensive Epilepsy Center, pubblicati sul New England Journal of Medicine nel 2017 confermano le proprietà benefiche del CBD quale terapia per l’epilessia infantile. Ad un totale di 120 pazienti con sindrome di Dravet, di età compresa tra i 2 e gli 18 anni, sono stati assegnati in modo casuale una soluzione orale di cannabidiolo o di placebo per un periodo di 14 settimane. Tra i bambini che assumevano cannabidiolo, la diminuzione della frequenza degli attacchi epilettici – che comportano perdita di coscienza, muscoli irrigiditi e convulsioni – è stata di 23 punti percentuali superiore rispetto alla diminuzione degli attacchi nei bambi.
L’Agenzia americana per i farmaci, Food and Drug Administration (FDA), ha attribuito la qualifica di farmaco orfano al cannabidiolo per il trattamento della sindrome di Lennox-Gastaut e per altre condizioni patologiche rare (trattamento della sindrome di Dravet, dell’encefalopatia neonatale ipossico ischemica, del glioma, della sindrome dell’X fragile, della sclerosi tuberosi, degli spasmi infantili, del glioblastoma multiforme, della schizofrenia pediatrica; prevenzione della malattia acuta da rigetto) (Food and Drug Administration – FDA, 2016).
1.3 Azione sui disturbi dell’umore
I disturbi dell’umore, detti anche disturbi affettivi, consistono in variazioni patologiche dell’energia vitale che, a loro volta, comportano variazioni della volontà, dell’iniziativa, dell’emotività e di tutte le attività psichiche in generale.
Un gran numero di studi, condotti su modelli animali di depressione, suggeriscono che la stimolazione diretta o indiretta (inibendo il re-uptake o la degradazione enzimatica degli endocannabinoidi) dei recettori CB1 ha un effetto antidepressivo-simile. Inoltre, diversi modelli animali di depressione sembra siano associati a una ridotta attività del sistema endocannabinoide. Al contrario, è stato recentemente dimostrato che il supposto effetto antidepressivo-simile del rimonabant, un antagonista dei recettori CB1, è in realtà un “falso positivo”, chiarendo cosi il paradosso di un farmaco considerato antidepressivo nell’animale, ma ritirato dal mercato per la sua capacità di provocare depressione e aumentare il rischio di suicidio nell’uomo.
L’ipotesi che la stimolazione dei recettori CB1 possa avere un effetto antidepressivo è coerente con l’esperienza clinica dell’uso della cannabis nell’uomo. Gli stimolanti diretti o indiretti dei recettori CB1 potrebbero essere quindi dei potenziali farmaci antidepressivi.
Studi condotti sul topo hanno eidenziato che il CBD vanta un effetto antidepressivo paragonabile a quello del principio attivo imipramina, antidepressivo triciclico normalmente impiegato quale terapia – studio condotto sui topi. Il CBD non determina alterazioni a livello dell’ippocampo. Anche il THC ha effetti antidepressivi a basse dosi – studio condotto sempre sui topi, dose 2.5 mg/kg.
Sono necessari studi condotti sull’uomo che confermino o meno gli effetti sopra indicati.
1.4 Azione antiemetica –emesi associata a chemioterapia
La parola chemioterapia letteralmente indica qualunque trattamento terapeutico a base di sostanze chimiche. Nel linguaggio comune, però, il termine è utilizzato soprattutto in riferimento alle più comuni cure farmacologiche rivolte contro il cancro. La chemioterapia ha un effetto diverso su ogni paziente. Alcune pazienti sviluppano solo pochi effetti collaterali, mentre altre ne manifestano di più. I diversi farmaci chemioterapici possono del resto comportare effetti collaterali differenti.
Un effetto collaterale che spesso insorge in seguito a chemio sono la nausea e il vomito. I farmaci antiemetici non sono sempre efficaci, in più possono avere anch’essi effetti collaterali sul sistema nervoso e causano sedazione.
Negli anni settanta vi erano già testimonianze sui benefici che l’inalazione di derivati della cannabis aveva sulla nausea causata dalla chemioterapia. In seguito è stato mosso l’interesse di alcuni scienziati su questi riferimenti, che hanno messo a confronto l’efficacia del THC con i farmaci antiemetici convenzionali o placebo. I risultati di questo esperimento hanno mostrato che l’efficienza del THC è superiore al placebo e al pari dei farmaci antiemetici, anche se questi ultimi hanno maggiori effetti collaterali. In più, di recente, è stato rilevato che gli endocannabinoidi hanno un ruolo importante nell’area postrema, deputata al controllo del vomito, dove infatti si trovano i recettori CB1. Allo stesso modo i cannabinoidi sintetici o naturali agiscono proprio in quelle aree stimolando i recettori CB1.
Nel 2001 è stata fatta una revisione sistematica di tutti gli studi pubblicati sull’argomento, e ne furono selezionati almeno trenta che rispondevano a criteri di estremo rigore scientifico che coinvolgono circa 1400 pazienti. In questi studi l’efficacia antiemetica dei cannabinoidi si è rivelata maggiore a quella dei farmaci convenzionali, come la proclorperazina (Stemetil), metoclopramide (Plasil), clorpromazina (neurolettico), tietilperazina (Torecan), aloperidolo (Serenase), domperidone (Peridon), alizapride (Litican).
Nonostante gli effetti collaterali fossero più frequenti nei pazienti trattati con i cannabinoidi, essi li preferivano ad altri farmaci. Alcuni di questi effetti, tra l’altro, erano graditi da alcuni pazienti (euforia, sedazione, leggerezza del capo). I dati statistici risultati da questi studi ci dicono che il 38-90% dei pazienti ha preferito i cannabinoidi, a discapito del 4-22% del placebo e il 3-46% degli altri farmaci. Più recentemente è stato osservato che il dronabinolo, che abbiamo trattato in precedenza, è risultato efficace come l’ondansetron nel trattamento di nausea e vomito correlati alla chemioterapia, la nausea è stata significativamente diminuita maggiormente nei pazienti sottoposti a terapia con dronabinolo (71%) rispetto a l’ondansetron (64%) e il placebo (15%).
Ancora una volta nel 2006 è stata effettuata un’altra revisione degli studi eseguiti fino a quell’anno ed è stata ribadita la superiorità dei cannabinoidi rispetto ai farmaci convenzionali e il placebo. Sono state eseguite cinque meta-analisi: dronabinolo contro placebo, dronabinolo contro neurolettici, levonantradolo contro neurolettici, e preferenza dei pazienti per la cannabis o per gli altri farmaci. Queste meta-analisi hanno di nuovo dimostrato che i cannabinoidi sono più efficaci nel trattamento di nausea e vomito.
1.5 Azione sulla sclerosi multipla
La sclerosi multipla è una patologia degenerativa accompagnata da spasticità muscolare, dolore, tremore, problemi di equilibrio, fatigue e incontinenza. La somministrazione della Cannabis in vivo è stata associata ad una riduzione del tremore, confermata anche dai dati clinici, sebbene in un numero limitato di pazienti (Clifford, 1983). Il beneficio terapeutico dei cannabinoidi è stato evidenziato anche in caso di spasticità (tetraidrocannabinolo, 7,5 mg) (Brenneisen et al., 1996; Ungerleider et al., 1987).
In pazienti affetti da sclerosi multipla, il consumo di Cannabis (fumo) è risultata efficace nel ridurre la percezione soggettiva del dolore cronico del 90% e della nevralgia da trigemino del 70% (Consroe et al., 1997).
In un altro trial, la somministrazione orale di Cannabis (estratto) oppure di tetraidrocannabinolo (THC) è stata correlata ad un miglioramento soggettivo della spasticità, degli spasmi, del dolore e della qualità del sonno in più del 50% dei pazienti trattati di età compresa fra 18 e 64 anni (durata del trattamento: 15 settimane).
Il tetraidrocannabinolo inoltre ha determinato un’incremento della mobilità dei pazienti, misurata come tempo impiegato per compiere una camminata di 10 metri. Né l’estratto di Cannabis né il tetraidrocannabinolo hanno però modificato la spasticità muscolare misurata dalla scala di Ashworth (misurazione oggettiva della spasticità) (Thompson et al., 2003). In un altro studio placebo-controllato, di durata pari a 6 settimana, la somministrazione dell’estratto standardizzato di Cannabis è risultata efficace nel ridurre il punteggio del Numerical Rating Scale per la spasticità (endpoint primario dello studio) (p=0,048), evidenziando un trend favorevole, ma non statisticamente significativo, anche per gli esiti clinici secondari di valutazione del grado di spasticità (Ashworth Score) e dell’intensità dello spasmo (misura soggettiva) (Collin et al., 2007).
In uno studio osservazionale non randomizzato, in aperto, non controllato, l’associazione tetraidrocannabinolo/cannabidiolo (1:1) in formulazione spray, somministrata per 40 settimane, è risultata efficace nel trattamento della spasticità (riduzione di 2,5 punti della scala di misurazione utilizzata, la Numerical Rating Scale o NRS, p<0,0001) e ha evidenziato miglioramenti significativi anche per la disfunzione vescicale (punteggio utilizzato: International Prostatic Symptoms Score, p = 0,001) e il dolore (scala utilizzata: NRS, p = 0,011). Il 36,2% dei pazienti ha interrotto la terapia; l’incidenza degli eventi avversi è risultata essere del 40,2%. Considerando l’esito clinico principale, la riduzione (30%) della spasticità osservata dopo il primo mese di terapia si è mantenuta per tutta la durata dello studio e i benefici migliori sono stati riscontrati nei pazienti che presentavano un punteggio di disabilità (Expanded Disability Status Scale, EDSS) iniziale più basso. Per quanto riguarda l’impatto sul dolore, l’estratto standardizzato di Cannabis è risultato efficace come terapia analgesica in pazienti che non erano riusciti ad ottenere una risposta antalgica soddisfacente con altre tipologie di farmaci (Paolicelli et al., 2015)
1.6 Azione sul dolore
Il dolore “è una esperienza emozionale e sensoriale spiacevole associata ad un danno tissutale acuto o potenziale, o descritto in tali termini” (definizione dell’International Association for the Study of Pain, IASP) (IASP Task Force on Taxonomy, 1994). Da questa definizione si evince come il dolore sia innanzi tutto una percezione e non un fenomeno sensoriale come la vista o l’udito o il gusto, risultante da una componente percettiva (nocicezione) legata alla trasmissione dello stimolo doloroso al cervello e da una componente legata all’esperienza che dipende esclusivamente dal soggetto, dal modo in cui percepisce e sperimenta la sensazione del dolore (la soglia del dolore, cioè il limite oltrepassato il quale una sensazione diventa dolore, è soggettiva). Il dolore quindi presenta una componente sensoriale-quantitativa in base alla quale è possibile definire intensità, durata e localizzazione, una componente emozionale che conferisce il tono del dolore (penoso, difficilmente sopportabile, spiacevole, aggressivo, etc.), una componente cognitiva che è in grado di modificare la percezione del dolore e i comportamenti indotti e una componente comportamentale che costituisce il modo con cui si esprime sia verbalmente sia non verbalmente l’individuo sofferente (Rigotti, 2006).
Il dolore nella sua forma transitoria è un sintomo di difesa dell’organismo, che permette di “correre ai ripari“ prima che si verifichi un danno tissutale importante (dolore come sintomo, cioè “fisiologico“). Il dolore come sintomo dovrebbe essere considerato il quinto segno vitale insieme a pressione arteriosa, frequenza cardiaca, frequenza respiratoria e temperatura corporea (JAMA, 1995).
Quando il dolore si protrae nel tempo e diventa cronico perde la sua funzione di “allarme“, provoca nel paziente cambiamenti fisici, ma soprattutto psicologici e sociali, con ricadute economiche, che gli conferiscono i caratteri di malattia vera e propria (dolore come malattia, cioè “patologico“).
La prima classificazione del dolore è quindi quella che distingue il dolore acuto e il dolore cronico.
Il dolore acuto è conseguenza di un trauma (es. frattura ossea, parto) o di un intervento chirurgico, ha un esordio definito nel tempo e si associa a iperreattività del sistema nervoso autonomo. L’entità del dolore acuto è correlata alla gravità del danno tissutale o al trauma (Mercadante, 2005).
Il dolore è definito cronico quando ha una durata superiore ai tre mesi e comporta cambiamenti nella vita propria e di relazione del paziente (Becker et al., 1997; Gureje et al., 1998). Nel dolore cronico, causato dalla ripetizione continua del segnale doloroso, si verificano alterazioni biochimiche e strutturali delle cellule nervose che diventano più sensibili allo stimolo doloroso e più resistenti ai meccanismi antinocicettivi. Le principali malattie associate a dolore cronico comprendono malattie osteoarticolari, cefalea, malattie muscolari, tumore, neuropatia centrale e periferica. Il dolore cronico non oncologico è definito anche dolore cronico benigno (definizione non da tutti condivisa).
Le aree del cervello deputate al controllo del dolore sono molto ricche di recettori per i cannabinoidi e stimolandoli si attiva un meccanismo di riduzione del dolore. L’azione antinocicettiva dei cannabinoidi agisce su vari livelli delle vie sensitive del dolore: a livello spinale, l’effetto analgesico sembra essere ottenuto dall’attivazione dei recettori K per gli oppioidi. Ciò è provato dal fatto che l’effetto analgesico viene annullato dalla somministrazione di antagonisti del recettore K direttamente nel liquor e anche di antisiero per questo recettore.
La sostanza grigia periacqueduttale (PAG) è una delle aree prevalentemente coinvolte nel meccanismo di analgesia provocato dai cannabinoidi. Ciò può essere correlato in parte all’inibizione di rilascio di GABA nel PAG e nel midollo, in parte all’inibizione del rilascio di glutammato. Infatti l’iperalgesia causata dall’antagonista dei recettori CB1 viene attenuata dalla somministrazione di antagonisti del recettore NMDA. L’attività dei recettori CB1 ha un feedback positivo per gli stimoli nocicettivi.
Un altro meccanismo analgesico indotto dai cannabinoidi è mediato dall’azione della dopamina sui recettori D2, essendo potenziata da agonisti e attenuata da antagonisti selettivi. In più il sistema endocannabinoide e oppioide, come già accennato, mostrano una relazione mediata dai recettori a livello spinale e sovraspinale: a livello spinale i cannabinoidi attivano i recettori K, mentre gli oppioidi attivano i recettori µ (Mu) e δ (delta); a livello sovraspinale l’azione dell’oppioide che viene mediata prevalentemente dal recettore µ, viene aumentata dai cannabinoidi che attivano i recettori K.
Una prima metanalisi sul dolore risale al 2001. Gli Autori concludevano che i cannabinoidi non erano più efficaci della codeina, e che il loro uso era associato a numerosi effetti indesiderabili. In realtà l’articolo, che oltretutto si basava su una casistica disomogenea e numericamente insufficiente a trarre conclusioni,115 se da un lato ridimensionava l’efficacia analgesica dei canna-binoidi nel dolore acuto (per esempio nel dolore postoperatorio), paragonandola a quella degli oppioidi minori, dall’altro riconosceva il potenziale ruolo terapeutico di queste sostanze in alcune forme di dolore cronico che non sempre rispondono agli oppioidi, quali per esempio il dolore da spasticità muscolare e il dolore neuropatico.
Lo studio apriva un decennio che è stato ricco di ricerche sia di laboratorio che cliniche. Infatti, successive sperimentazioni cliniche della durata che varia da giorni a mesi, che hanno coinvolto più di mille pazienti, hanno dimostrato l’efficacia dei cannabinoidi nel dolore cronico neuropatico di tipo centrale.
Già nel 1990 uno studio in doppio cieco su caso singolo di lesione spinale aveva dimostrato che THC e codeina avevano effetto analgesico in confronto al placebo. Wade e collaboratori hanno studiato un gruppo di pazienti con dolore neuropatico di varia origine (SM, lesione spinale, lesione del plesso brachiale e dolore da amputazione) non responsivi ai trattamenti standard. Estratti di cannabis hanno migliorato i sintomi neuro-genici, con effetti collaterali generalmente ben tollerati.
Lo studio CAMS (Cannabinoidi per il trattamento della spasticità e degli altri sintomi correlati alla SM) ha dimostrato che i cannabinoidi non avevano effetti sulla spasticità controllata con la scala di Ashworth, tuttavia i pazienti riferivano riduzione di dolore e spasticità.
Nello studio di Karst e collaboratori è stato utilizzato il cannabinoide sintetico CT-3, che si è dimostrato efficace nella riduzione del dolore rispetto al placebo. I differenti gruppi di pazienti non riportavano però intensità di dolore simile basale, fatto che potrebbe risultare in una sorgente di bias riguardo ai risultati finali.
Lo studio di Notcutt e collaboratori è stato effettuato su malati con dolori cronici, specialmente neuropatici, con riduzione del dolore. Gli effetti collaterali sono stati comuni, ma di scarsa entità e simili a quelli che si riscontrano con l’uso di farmaci psicoattivi usati per il dolore cronico.
L’analogo sintetico del THC, dronabinolo, ha dimostrato significativo effetto analgesico in pazienti con SM.121 Berman e collaboratori hanno invece studiato pazienti con dolore da avulsione del plesso brachiale; accanto alla riduzione del dolore si è avuto anche miglioramento del sonno. Ancora il THC-CBD, estratto di cannabis, è stato utilizzato in malati di sclerosi multipla, e anche qui si è avuto miglioramento sia del dolore che del sonno.
Nella neuropatia sensoriale HIV correlate la cannabis in forma di sigarette si è dimostrata efficace nel ridurre il dolore ed è stata ben tollerata; la prima somministrazione di cannabis ha ridotto il dolore del 72 per cento mentre il placebo del 15 per cento. I risultati sono comparabili a quelli degli altri farmaci orali utilizzati.
125 pazienti affetti da dolore neuropatico di origine periferica trattati con Sativex hanno avuto riduzione del dolore e dell’allodinia, con miglioramento del sonno, del Pain Disability Index e del Patient’s Global Impression of Change. Il derivato dronabinolo si è inoltre dimostrato efficace come adiuvante in pazienti con dolore cronico che non rispondevano in modo adeguato agli oppioidi. Altri due studi hanno utilizzato sigarette di Cannabis somministrate in maniera standardizzata, dimostrando riduzione del dolore e con effetti psicoattivi minimi e ben tollerati.
Nel 2000, alcune relazioni che dimostravano che il CBD potesse modulare il fattore di necrosi tumorale in vitro e inibire la produzione delle chemochine da una cellula umana B, hanno incentivato lo studio del CBD come agente terapeutico nell’artrite indotta da collagene, un modello per l’artrite reumatoide. Tale modello si basa sull’immunizzazione dei topi con collagene di tipo II. Il CBD, somministrato i.p. o per via orale, ha bloccato la progressione dell’artrite. Una dose-dipendenza è stata mostrata da una curva a campana, con un effetto ottimale a 5 mg/kg/die (ip), o 25 mg/kg/die (via orale). Inoltre, il CBD ha inibito le risposte delle cellule T e ha diminuito il rilascio del fattore bioattivo di necrosi tumorale (TNF) da parte cellule sinoviali isolate nell’articolazione del ginocchio affetto da artrosi in topi trattati. I dati di questo studio suggeriscono che l’effetto di antiartritico del CBD è dovuto ad una combinazione di azioni immunosoppressive ed anti-infiammatorie.
L’effetto antinfiammatorio del CBD è stato osservato in infiammazioni acute indotte da iniezioni intraplantari di 0,1 ml di carragenina nel ratto. La somministrazione orale di CBD (5-40 mg/kg) una volta al giorno per 3 giorni dopo l’insorgenza dell’infiammazione acuta ha avuto un’azione benefica sull’edema e sull’iperalgesia. Il CBD ha dimostrato di essere efficace anche negli stati dolorosi cronico neuropatici (costrizione cronica del nervo sciatico) nei ratti, riducendo iperalgesia a stimoli meccanici. Questo effetto è stato contrastato dalla capsazepina (antagonista del recettore vanilloide) ma non dagli antagonisti dei recettori cannabinoidi. In questi modelli di infiammazione, sono state osservate una diminuzione dei livelli plasmatici della prostaglandina E2 (PGE2), dell’attività del tessuto cicloossigenasi (COX) e della produzione di ossido nitrico (NO). Gli effetti inibitori del CBD sulle risposte immunitarie cellulari e sulla produzione di mediatori pro-infiammatori suggeriscono l’utilità di questa sostanza nel trattamento di diverse malattie infiammatorie.
1.7 Azione sull’ischemia
Le proprietà antiossidanti e anti-infiammatorie del CBD hanno indotto i ricercatori a studiare la sua possibile funzione nella prevenzione dei danni causati da ischemia cerebrale. IL CBD (1,25-20 mg/kg) è stato somministrato a gerbilli in libero movimento, 5 min. dopo un’occlusione bilaterale dell’arteria carotide di 10 min. Sette giorni dopo l’ischemia, il CBD antagonizzava l’appiattimento elettroencefalografico, mostrando una curva a campana dose-dipendente. Il migliore effetto neuroprotettivo è stato osservato a 5 mg/kg. L’esame istologico ha mostrato la completa sopravvivenza dei neuroni CA1 in gerbilli trattati con il CBD. Un effetto simile è stato riportato da un altro gruppo di ricercatori che hanno studiato i topi, dopo l’occlusione dell’arteria cerebrale media; l’azione neuroprotettiva del CBD non è stata influenzata dal blocco del recettore CB1. Lo stesso gruppo di ricercatori ha verificato che questo effetto viene inibito dal WAY100135, antagonista del recettore di serotonina 5-idrossitriptamina 1A (5-HT1A), ma non dal capsazepine, antagonista del recettore vanilloide, suggerendo che l’effetto neuroprotettivo del CBD può essere derivato dall’aumento del flusso sanguigno cerebrale mediato dal recettore serotoninergico 5-HT1A. Prove sperimentali suggeriscono che oltre all’azione sul recettore 5-HT1A, l’effetto protettivo del CBD sui danni ischemici è anche secondario alla sua azione anti-infiammatoria. In un altro studio, lo stesso gruppo di ricercatori ha dimostrato che, mentre il trattamento ripetuto col delta9-THC porta a sviluppare una tolleranza per questo effetto neuroprotettivo, tale fenomeno non si osserva col CBD.
Il CBD è stato studiato per le malattie cardiache ischemiche nei ratti. Il ramo discendente anteriore dell’arteria coronaria sinistra è stato transitoriamente ostruito per 30 min., e i topi sono stati trattati per 7 giorni con il CBD (5 mg/kg, ip) o con il veicolo. Il funzionamento cardiaco è stato monitorato mediante ecocardiografia e ha mostrato la conservazione della frazione di accorciamento negli animali trattati con il CBD. La portata dell’infarto è stata ridotta del 66% negli animali trattati con il CBD e questo effetto è stato associato alla riduzione dell’infiammazione miocardica e alla riduzione dei livelli di IL-6. In cuori isolati, nessuna differenza significativa è stata rilevata tra ratti trattati col CBD o con il veicolo, per quanto riguarda: la dimensione infartuale, la pressione ventricolare sinistra sviluppata durante l’ischemia e la riperfusione, o il flusso coronarico. Lo studio dimostra che il CBD induce un sostanziale effetto cardioprotettivo, ma solo in vivo.
1.8 Azione sul diabete
Un tempo il diabete mellito ditipo 1 veniva chiamato anche diabete insulino-dipendente o diabete giovanile. Si tratta di una malattia autoimmune che insorge quando le cellule beta del pancreas, deputate alla produzione dell’insulina necessaria alla regolazione della glicemia, vengono distrutte dal sistema immunitario dell’organismo stesso. Il diabete tipo 1 è più frequente in bambini e giovani adulti, ma può colpire persone di qualsiasi età. Chi soffre di diabete mellito di tipo 1 necessita di somministrazioni di insulina per tutta la vita, finora non esistono possibilità di guarigione.
L’effetto anti-infiammatorio del CBD, con riduzione della produzione di citochine (IFN-γ e TNF-α) e l’inibizione della proliferazione delle cellule T osservati nell’artrite sperimentale, ha indotto i ricercatori a studiare i possibili effetti del CBD su altre malattie autoimmuni. Il diabete mellito di tipo 1 (insulino-dipendente) è una malattia autoimmune che provoca la distruzione delle cellule pancreatiche β che producono insulina. La lesione iniziale determinata dal diabete mellito insulino-dipendente è un’infiammazione delle isole di Langerhans, durante la quale, i leucociti, in particolare i linfociti, circondano e si infiltrano negli isolotti. Il gruppo di Mechoulam ha studiato l’azione del CBD su topi diabetici non-obesi (NOD). I ricercatori hanno scoperto che il trattamento col CBD di topi NOD, prima dello sviluppo della malattia, ha diminuito l’incidenza dall’86%, nei topi di controllo non trattati, al 30%, nei topi trattati con il CBD. Il trattamento col CBD ha anche determinato una riduzione significativa dei livelli plasmatici di citochine pro-infiammatorie, IFN-γ e TNF-α. L’esame istologico delle isole pancreatiche dei topi trattati con il CBD ha rivelato una riduzione significativa dell’infiammazione.
È stato osservato che la somministrazione di CBD in giovani topi femminili NOD di 11-14 settimane, in fase di diabete latente o che presentavano sintomi iniziali di diabete, ha determinato un miglioramento nella manifestazione della malattia. Inoltre, il livello di citochina IL-12 pro-infiammatoria prodotta dai splenociti è stato significativamente ridotto, mentre il livello dell’anti-infiammatorio IL-10 è rimasto significativamente elevata dopo il trattamento col CBD. Questi dati hanno suggerito che il CBD può essere eventualmente utilizzato come agente terapeutico per il trattamento del diabete di tipo 1.
L’utilità del CBD è stata dimostrata anche in possibili complicazioni del diabete. La maggior parte di tali complicanzioni è associata ad alterazioni fisiopatologiche nel sistema vascolare. Le complicazioni microvascolari implicano retinopatia e nefropatia, mentre l’aterosclerosi è una complicazione macrovascolare più comune del diabete. Gli effetti protettivi del CBD sono stati studiati nel diabete sperimentale indotto da streptozotocina nei ratti. Il trattamento col CBD ha impedito la morte delle cellule della retina e l’iperpermeabilità vascolare nella stessa. Inoltre, ha ridotto in modo significativo lo stress ossidativo, ha ridotto i livelli di TNF-α, del fattore di crescita dell’endotelio vascolare. È stato anche fatto presente che il CBD ha notevoli benefici terapeutici contro altre complicazioni del diabete e dell’aterosclerosi, in quanto ha attenuato vari effetti derivati dal glucosio alto, ivi compresa l’interruzione della funzione endoteliale.
1.9 Azione antiossidativa e neuroprotettiva
Alla fine degli anni ‘90, è stato dimostrato che il CBD riduce la tossicità del glutammato mediata dai recettori N-metil-D-aspartato (NMDA), recettori AMPA acido 2-ammino-3 (4-butil-3-idrossi-isoxazole -5-metil) propionico o recettori del kainato. La neuroprotezione osservata con il cannabidiolo non è stata influenzata da un antagonista del recettore dei cannabinoidi, e questo indica che non dipende dai recettori dei cannabinoidi. Studi precedenti avevano dimostrato che la tossicità del glutammato può essere contrastata con antiossidanti. In linea con questo dato, è stato dimostrato che il CBD può ridurre il danno ossidativo indotto da idroperossidi così come, o addirittura meglio di altri antiossidanti. Il CBD era più protettivo contro la neurotossicità del glutammato rispetto all’ascorbato e all’a-tocoferolo, indicando che questo farmaco rappresenta un potente antiossidante.
L’azione antiossidante del CBD può essere all’origine della neuroprotezione riscontrata nei modelli animali della malattia di Parkinson (PD). La somministrazione giornaliera del CBD per 2 settimane può produrre un declino significativo nella portata degli effetti tossici causati da una iniezione unilaterale di 6-idrossidopamina nel fascio proencefalo mediale, probabilmente a causa di un’azioni recettore-indipendente. In questo modello della PD, il CBD ha portato a una sovraregolazione dei livelli di mRNA del Cu/Zn superossido dismutasi, un
enzima chiave nella difesa endogena contro lo stress ossidativo. La conclusione è stata che le proprietà antiossidanti del CBD possono fornire una neuroprotezione contro la progressiva degenerazione dei neuroni dopaminergici nigrostriatali che si verifica nella PD. Tale conclusione è confortata dalla constatazione per cui il CBD riduce l’atrofia striata causata dall’acido 3-nitropropionico, in vivo, attraverso meccanismi indipendenti
dall’attivazione dei recettori dei cannabinoidi, dei vanilloidi TRPV1 e dei recettori a2a dell’adenosina. L’azione neuroprotettiva del CBD nei gangli basali umani è stata suggerita dalla forte correlazione positiva fra il rapporto N-acetilaspartato/creatina totale e il CBD nel putamen/globus pallidus riscontrata nei consumatori di cannabis a scopo ricreativo. Questo potrebbe riflettere un miglioramento da CBD dell’integrità neuronale e assonale in queste regioni. Considerando la rilevanza di questi dati preclinici e il possibile effetto antipsicotico del CBD, per la prima volta, un recente studio ha valutato l’efficacia, la tollerabilità e la sicurezza del CBD in pazienti PD con sintomi psicotici. In uno studio pilota, aperto, sei pazienti ambulatoriali con diagnosi della PD e con affetti da psicosi da almeno 3 mesi, hanno ricevuto un regime a dosaggio flessibile di CBD (iniziando con una dose orale di 150 mg/die) per quattro settimane, in aggiunta alla loro terapia usuale. I sintomi psicotici sono significativamente diminuiti, col trattamento CBD, e la scala utilizzata per seguire lo sviluppo della PD hanno mostrato una diminuzione del punteggio totale. Questi dati preliminari suggeriscono che il CBD può esercitare un’azione benefica per la PD.
La possibile azione neuroprotettiva del CBD sottolinea l’importanza degli studi sul suo potenziale terapeutico nella malattia di Alzheimer (AD). L’AD è generalmente associata allo stress ossidativo dovuto in parte, all’azione membranica degli aggregati di peptide beta-amiloide (beta-A). Una netta riduzione della sopravvivenza delle cellule è stata osservata dopo l’esposizione al beta-A peptide di cellule PC12 (feocromocitoma di ratto). Il trattamento delle cellule con il CBD prima dell’esposizione al beta-A ha significativamente incrementato la sopravvivenza cellulare; ciò è probabilmente dovuto a una combinazione di effetti neuroprotettivi, antiossidanti e anti-apoptotici contro la tossicità del beta-A. Inoltre, il CBD ha inibito la generazione di caspasi-3, dal suo percussore inattivo (pro-caspasi 3), effetto che appare nel percorso di segnalazione di questa neuroprotezione. Nella ricerca del meccanismo molecolare dell’azione neuroprotettiva indotta dal CBD è stato riferito che tale sostanza inibisce l’iperfosforilazione delle proteine tau nelle cellule neuronali PC12 esposte al beta-A, una delle caratteristiche più rappresentative della AD. Una possibile azione anti-infiammatoria può essere inoltre coinvolta in questo effetto, dato che il CBD ha inibito la produzione di nitriti nonché l’espressione proteica della sintesi di ossido nitrico (iNOS) indotta da beta-A. Questi risultati, ottenuti in studi in vitro, sono stati confermati, in vivo, con un modello murino di neuroinfiammazione correlata alla AD. Beta-A umano è stato inoculato nell’ippocampo dorsale destra, di topi trattati poi giornalmente con il veicolo o con il CBD (2,5 o 10 mg kg, ip) per 7 giorni. In contrasto al veicolo, il CBD dose-dipendente ha significativamente inibito l’mRNA per la proteina fibrillare acida della glia. Inoltre, nelle stesse condizioni sperimentali, il CBD ha ridotto l’iNOS e l’espressione della proteina IL-1beta, nonché il relativo rilascio di NO e di IL-1beta. La possibilità che il CBD inibisca la neurodegenerazione beta-A-indotta è molto promettente per la prevenzione dell’AD. Recentemente, i ricercatori ritengono che il CBD possa proteggere i neuroni contro i fattori cellulari e multimolecolari coinvolti nelle diverse fasi del processo neurodegenerativo, che avviene durante un’infezione prionica. Malattie prioniche sono patologie neurodegenerative trasmissibili caratterizzate dall’accumulo nel SNC di proteina prionica resistente alle proteasi, una isoforma strutturalmente mutata della fisiologia.
1.10 Azione antipsicotica
Il termine “psicosi” fu introdotto nel XIX secolo con il significato di malattia mentale o follia. Successivamente è emersa, sul piano concettuale, la necessità di suddividere alcune di queste malattie con la denominazione nevrosi. Da allora i due termini hanno avuto un’evoluzione che si è espressa su piani diversi.
Attualmente con disturbo psicotico si intende un disturbo psichiatrico grave caratterizzato da un distacco dall’ambiente che lo circonda, da forti difficoltà ad iniziare delle attività e a provare sentimenti autentici nei confronti delle altre persone; c’è quindi una grave alterazione dell’equilibrio psichico dell’individuo con compromissione dell’esame di realtà e disturbi formali del pensiero.
Tali disturbi hanno come caratteristica predominante i sintomi psicotici, raggruppabili in:
- Disturbi di forma del pensiero: alterazioni del flusso ideico, fino alla fuga delle idee e all’incoerenza, alterazione dei nessi associativi;
- Disturbi di contenuto del pensiero: ideazione prevalente o delirante (i cosiddetti deliri); in particolare, è molto nota la cosiddetta paranoia.
- Disturbi della sensopercezione: allucinazioni uditive, visive, olfattive, tattili, gustative.
I principali disturbi psicotici o forme di psicosi sono: Schizofrenia, Disturbo delirante, Disturbo schizofreniforme, Disturbo schizoaffettivo, Disturbo psicotico breve.
Il trattamento delle psicosi punta a ristabilire un corretto funzionamento biochimico del sistema nervoso centrale. Generalmente il trattamento della psicosi, soprattutto nella fase acuta, è di tipo farmacologico, al quale è fondamentale associare un intervento psicoterapeutico – riabilitativo. Tali interventi hanno come obiettivo principale l’insegnamento delle abilità sociali; un lavoro con la famiglia attraverso interventi psicoeducazionali sulla psicosi che aiutino i familiari ad affrontare la malattia e promuovono il loro reciproco aiuto; specifici interventi psicologici cognitivo-comportamentali con la persona stessa.
La prima prova dell’effetto antipsicotico del CBD è emersa in uno studio condotto nel 1982, su volontari sani con lo scopo di indagare l’interazione tra il CBD e il delta9-THC. Tale studio ha dimostrato che il CBD potrebbe avere un’azione inibitoria sulle percezioni soggettive, indotte dal THC e simili ai sintomi di malattie psicotiche quali: processi mentali interrotti, alterazione percettiva, depersonalizzazione e difficoltà di comunicazione. Nello stesso anno, osservazioni sui pazienti ricoverati in un ospedale psichiatrico in Sudafrica, dopo l’uso di una varietà di cannabis quasi del tutto priva di CBD, hanno mostrato un numero di episodi psicotici acuti molto più elevato rispetto ad altri paesi. Queste attestazioni hanno promosso altre ricerche su una possibile azione antipsicotica del CBD.
Nei primi studi sulle proprietà antipsicotico-simili del CBD in modelli animali, il farmaco è stato confrontato con l’aloperidolo nei ratti. Entrambi i farmaci hanno ridotto, in maniera dose-dipendente, il comportamento (es.: fiutare e mordere) stereotipato indotto dall’apomorfina. Anche se questi farmaci hanno aumentato il livello plasmatico della prolattina, il CBD determina tale effetto soltanto a dosi elevate (120 e 240 mg/kg). Inoltre, il CBD, contrariamente all’aloperidolo, non ha indotto catalessi, anche ad alte dosi (480 mg/kg). Questi risultati suggeriscono che il CBD può presentare un profilo simile ai farmaci antipsicotici atipici. In uno studio recente, i ricercatori hanno testato gli effetti del CBD nei modelli della dopamina e del glutammato, entrambi predittivi dell’attività antipsicotica nei topi. Il CBD è stato confrontato con l’aloperidolo e il clozapina, un antipsicotico atipico. Il CBD ha inibito l’iperlocomozione indotta da anfetamina, in maniere dose-dipendente (in conformità con i dati ottenuti in un altro modello della dopamina), e ha inoltre attenuato l’iperlocomozione indotta da ketamina, estendendo la sua azione antipsicotico-simile al modello del glutammato. Come previsto, l’aloperidolo e la clozapina hanno inibito l’iperlocomozione, ma solo l’aloperidolo ha indotto catalessi, nella gamma di dosaggio utilizzata; analogamente alla clozapina, il CBD non ha indotto
catalessi con dosi inibenti l’iperlocomozione. Questi risultati sono stati confortati dall’interruzione determinata dal CBD nel deficit nella PPI (propulse inhibition, riflesso da spavento) nei topi indotto dal MK-801, un antagonista del recettore del glutammato, rafforzando ulteriormente l’idea che questa sostanza può agire come antipsicotico atipico. In linea con i dati sui modelli comportamentali, sia il CBD che la clozapina, ma non l’aloperidolo, hanno indotto l’immunoreattività di Fos nella corteccia prefrontale; soltanto l’aloperidolo ha aumentato il Fos nello striato dorsale.
L’attività antipsicotico-simile del CBD può essere dimostrata anche nei modelli umani che studiano i sintomi psicotici indotti in volontari sani. Nell’inversione della percezione della profondità binoculare, impiegata per valutare gli effetti di nuovi farmaci antipsicotici, l’alterazione della percezione dell’immagine illusoria indotta dal nabilone è attenuata dal CBD, risultato che suggerisce un effetto antipsicotico-simile. Un altro modello utilizzato per valutare l’attività antipsicotico-simile del farmaco, in volontari sani, prevede la somministrazione di dosi sub-anestetiche di ketamina che induce una reazione psicotica che imita i sintomi positivi e negativi della schizofrenia. Una procedura in doppio cieco crossover che impiega questo modello è stata condotta per confrontare gli effetti del CBD (600 mg) e del placebo in nove volontari sani. Il CBD ha attenuato gli effetti della ketamina sul fattore depersonalizzazione su una scala di rating dissociativo, rafforzando ulteriormente le sue proprietà antipsicotico-simili.
Nel 1995, il CBD è stato utilizzato per la prima volta a fini terapeutici in pazienti psicotici. In un case study, dosi di CBD (fino a 1500 mg/die) sono state somministrate, per os e per 4 settimane, ad un paziente schizofrenico, che presentava gravi effetti collaterali dopo il trattamento con antipsicotici convenzionali. Durante il trattamento è stato osservato un miglioramento significativo, mentre un peggioramento è stato osservato all’interruzione della somministrazione. Di recente, il CBD è stato somministrato a tre pazienti schizofrenici che non avevano risposto ai farmaci antipsicotici tipici. Un miglioramento parziale è stato osservato in un paziente, mentre negli altri due pazienti è stato riscontrato solo un lieve o nessun miglioramento; il risultato suggerisce che il CBD ha scarso effetto in pazienti resistenti agli antipsicotici tipici. La conferma delle indicazioni derivate dai case study è stata fornita da una relazione preliminare di uno studio clinico di 4 settimane in doppio cieco controllato; tale studio impiegava un numero adeguato di pazienti e confrontava gli effetti del CBD con l’amisulpride in psicosi schizofrenica acuta e schizofreniforme, dimostrando che il CBD riduceva significativamente i sintomi acuti psicotici dopo 2 e 4 settimane di trattamento, in riferimento agli indici di base. In questo studio, il CBD non differiva dall’amisulpride, ad eccezione fatta per una minore incidenza degli effetti collaterali. In conclusione, gli studi clinici suggeriscono che il CBD è un trattamento alternativo efficace, sicuro e ben tollerato dai pazienti schizofrenici.
1.11 Azione antitumorale
A metà degli anni ‘70, diversi cannabinoidi, compreso il CBD, sono stati studiati in cellule tumorali e i risultati osservati con il CBD non erano promettenti. Tuttavia, gli esperimenti venivano condotti con dosi molto elevate (ad es. 200 mg/kg) ed è improbabile che queste osservazioni siano rilevanti per le usali dosi di CBD. Un rinnovato interesse per il CBD come potenziale farmaco antitumorale è emerso nel 2000, con uno studio del suo effetto sulle cellule di glioma. Nello studio, il CBD ha prodotto una modesta riduzione della vitalità delle cellule di glioma C6 nel ratto, evidente dopo 6 giorni di incubazione con il farmaco e solo in condizione senza siero. Un altro studio ha dimostrato che il CBD, in vitro, ha determinato un’inibizione correlata alla concentrazione della vitalità cellulare di glioma umano, evidente 24 ore dopo l’esposizione al CBD che ha inibito significativamente la crescita delle cellule di glioma umano impiantate in modo sottocutaneo in topi nudi. Per la prima volta, i ricercatori hanno constatato che l’effetto antiproliferativo del CBD è correlato all’induzione di apoptosi, come dimostrato dalle analisi citofluorimetriche e della colorazione del DNA a singolo filamento, e che non è stato ricondotto dai cannabinoidi e dagli antagonisti dei recettori vanilloidi.
Il CBD ha anche determinato l’apoptosi in cellule umane leucemiche mieloblastich. Inoltre, il CBD inibisce la migrazione di cellule di glioma umano U87, in vitro, e tale effetto non è stato contrastato dagli antagonisti selettivi dei recettori CB1 o CB2. Uno studio degli effetti di diversi cannabinoidi su otto linee di cellulari tumorali, in vitro, ha dimostrato che, dei cinque composti naturali testati, il CBD era il più potente inibitore della crescita delle cellule tumorali. Nello studio, due diverse linee cellulari tumorali trapiantate in topi nudi erano la metà, per grandezza, di quelle del gruppo non trattato; le cellule cancerogene del seno e dei polmoni
iniettate nelle zampe hanno mostrato una diffusione metastatica di circa tre volte inferiore. Un inibitore dei fattori generali di trascrizione elica-ansa-elica (Id1) è stato recentemente scoperto quale regolatore fondamentale del potenziale metastatico dei tumori al seno e diffusi. Il CBD potrebbe sottoregolare l’Id-1 nelle cellule di tumore aggressivo al seno umano, nonché le concentrazioni efficaci nell’inibire l’espressone dell’Id-1 correlata con quelle utilizzate per inibire il fenotipo proliferativo ed invasivo delle cellule del tumore al seno. Il preciso meccanismo che sottende gli effetti del CBD sull’apoptosi e la crescita del tumore non sono chiare, e sono stati discussi in un recente articolo di Mechoulam.
Fonte: purexis.ch




